新生儿出院后黄疸高企不退,在缺乏有效检测手段的情况下,造成胆红素脑病并转成脑瘫,是成千上万家庭迎来新生命之后面对的首要难题之一。
日前,由启元财富兄弟公司元景医疗孵化的医疗创新企业「贝申医疗」,获得广东省药监局颁发的《新生儿黄疸筛查手机软件》医疗器械注册证,标志着由其开发推出的新生儿黄疸检测APP软件“哪吒保贝”,正式获得官方许可。此项目是目前已知唯一的新版分类目录实施后获得官方许可上市的决策支持软件医疗器械注册证,并同时创下多个第一:国内第一张基于AI技术的手机APP医疗器械注册证,第一个完成GCP临床试验的人工智能医疗器械,第一个获得国家自然科学基金支持的医疗AI项目等。
注册证是医疗器械产品的上市许可,而要获得注册证,必须严格按照法规完成包括产品注册检验、GCP临床试验、企业质量体系考核、临床试验现场检查、产品注册专家评审会、技术审评、行政审批等一系列流程。近年来,国内“医疗AI”概念炙手可热,其中有相当一部分并不具备医疗器械开发价值,无法获取上市许可,但是拿到产品出生证的标的,将获得资本的追捧并脱颖而出。
恭喜贝申医疗,恭喜元景医疗和母公司景元天成!
手机拍照即可检测新生儿黄疸,「贝申医疗」获医疗器械注册证
来源:36氪
作者:汝晴
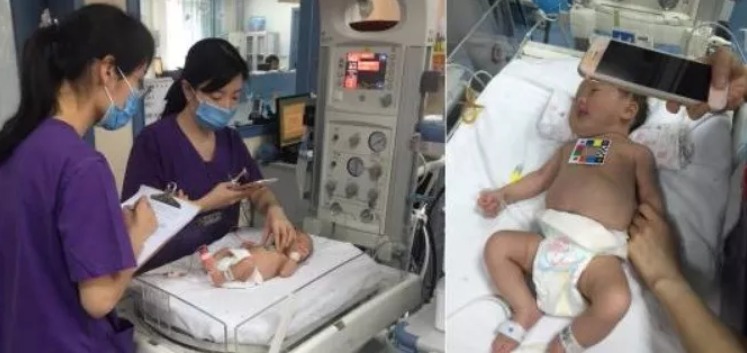
将比色卡平放紧贴在新生儿的胸口皮肤上,打开软件根据指引自动扫描拍照(关闭美颜等功能),即刻便可获取黄疸数值,提示医生和宝爸宝妈们新生儿的黄疸风险级别。这是新生儿黄疸检测软件「哪吒保贝」APP最基础的院外随访和监护功能。
哪吒保贝是由深圳贝申医疗技术有限公司(以下简称“贝申医疗”)研发推出的新生儿随访APP。1月底贝申医疗已获得由广东省药监局颁发的《新生儿黄疸筛查手机软件》医疗器械注册证,这是目前已知唯一的新版分类目录实施后获得官方许可上市的决策支持软件医疗器械注册证。
“注册证是医疗器械产品的上市许可。这意味着哪吒保贝可以进入医院正规采购流程。”贝申医疗CTO申田说。
在我国,新生儿黄疸发生率在60%-80%左右,每年因黄疸导致的脑瘫患儿不低于1万例。因黄疸导致的胆红素脑病可防不可治,多转为脑瘫。此病在我国的发病率远高于欧美发达国家。我国产科病床紧张周转快, 一般顺产72小时出院,不少医院甚至24小时出院。然而新生儿出生后4-6天怡恰是黄疸高发期,家长缺乏黄疸判断经验且黄疸病情变化进展很快,社区医生随访可能不及时,这就使得无创、简便、准确、低成本的新生儿出院后的黄疸筛查成为市场必需。
根据哪吒保贝的测算,2018年我国新生儿数量1523万(国家统计局数据),每位新生儿在新生儿期内(28天)都需要每天监测黄疸,以每人收费100元计每年市场容量15-16亿元。
哪吒保贝的主要应用场景是产妇出院后的30天内家庭环境下的新生儿黄疸检测和风险提示。目前医院进行黄疸检测主要有两种方式,一种是抽血检测,此种方法最为准确,被称为黄疸检测“金标准”,但是有创且无法在院外进行;第二种是利用专业经皮黄疸仪进行辅助诊断,这种机器每台价格在5-10万元不等,价格高昂不适合在家庭推广。
与它们相比,哪吒保贝运用人工智能大数据+医学图像处理技术,根据新生儿黄疸临床诊断标准——小时胆红素曲线图评估风险,特点是无创、远程、简便、可靠。其技术原理是,通过建立新生儿胎龄、时龄、体重及血清总胆红素值、临床黄疸皮肤样本等数据的集合数据库,利用图像处理分析等技术,训练智能程序根据实时上传的被检测新生儿皮肤样本自动计算并返回黄疸数值,提示风险级别。
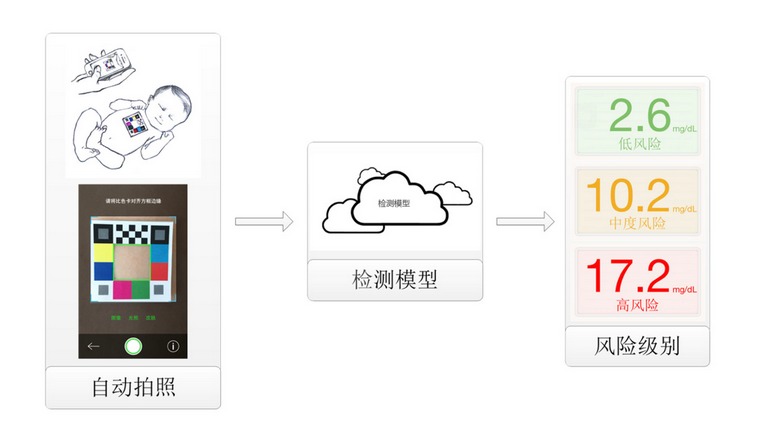
哪吒保贝的运行模式
“哪吒保贝起到黄疸的风险预警作用,而非替代医生决策,我们的目的是提示新生儿父母及时带孩子去医院就诊,避免更严重的病情发生。”申田补充说
截至目前,哪吒保贝医院用户超过1000家。在检测准确度及安全性方面,开展了准确性大数据验证试验,其临床试验评估两次刊登于国内权威医学期刊上,其结论是“哪吒保贝准确性不劣于经皮黄疸仪”,与“金标准”结果具有较强一致性。
除了学术著作,贝申医疗在2016年底提交“创新医疗器械特别审批”,目前已经获得了医疗器械注册证,而要获得注册证,必须严格按照法规完成包括产品注册检验、GCP临床试验、企业质量体系考核、临床试验现场检查、产品注册专家评审会、技术审评、行政审批等一系列流程。这个项目在预研究阶段就获得了2017年度国家自然科学基金的支持,是第一个获得国自然支持的移动医疗项目。
截至目前,哪吒保贝已经国内30多家省区级重点医院进行合作,开展新生儿黄疸大数据研究。包括北京协和医院、南京妇幼保健院、复旦儿科医院、海南妇幼、华中科技大学附属同济医院、浙江大学医学院附属儿童医院、深圳市宝安区妇幼保健院等。
盈利模式上,未来收入主要来源于向用户收取的黄疸随访服务费,以及医院和社区医疗的技术服务费用。
产品方面,除了新生儿黄疸检测外,哪吒保贝还提供新生儿大便检测,主要用于28天后180天内幼儿胆汁淤积症的筛查,以及产前胎心、胎动、宫缩监控,产后新生儿脑发育监控的功能。
哪吒保贝功能截图界面
此外,哪吒保贝还与美国费城儿童医院、斯坦福儿童医院、南非开普敦儿童医院、墨西哥儿童医院、印度新德里儿童医院开展国际多中心研究,未来还将继续医学图像技术领域的开拓,开发出可以应用于白色、黑色人种新生儿的黄疸检测技术。
团队方面,其创始人团队是由一批来自妇产医学、人工智能图像处理和通讯技术行业的专业人士组成。联合创始人申田是美国里海大学计算机博士学位,先后就职于美国国立卫生中心、西门子研究院和华海医疗。姜向阳则有20多年的产科临床经验。闫升从事医学图像处理专业8年,负责图形图像处理算法,人工智能和机器学习开发。聂涛是移动通讯专家,毕业于北京大学,曾任职于摩托罗拉公司。
小知识:
1、医疗器械的分类属于管理分类而不是技术分类
注册证是医疗器械产品的上市许可。依据满足产品预期用途使用风险的不同,医疗器械分为一、二、三类管理,分别由各级药监局受理和审批(一类为备案)。医疗器械的分类管理和产品本身实现预期用途的技术原理、结构组成没有必然关系。一些行业外人士提到的三类器械的技术水平和价值高于二类器械的说法是不成立的。
例如,与传染病病原体、肿瘤相关的诊断治疗器械都属于三类,其中就包含了大量的诊断试剂,此类试剂的技术原理和生产工艺并不复杂。同样,也不能认为常用的属于二类医疗器械的水银式体温计的价值就低于按三类管理的MRI一样。这样的例子有很多。 随着产品技术工艺的成熟,依据产品风险的降低也可以调整分类,如2018年8月1日执行的最新医疗器械分类目录中,“射频消融设备用灌注泵”由原来的三类管理调整为二类管理。将2002版分类目录的“6870-2诊断图象处理软件”中的X射线影像处理系统、核医学成像、医用磁共振成像系统等管理类别降为第二类。
不同行业都有类似的风险控制措施,比如在交规中依据车辆的使用风险,小型乘用车驾驶执照是C照管理,公交车的驾驶执照是A 照,不能因此断定公交车的技术含量产品质量比小型车要高或低。因此,一个优秀的研发人员应当紧紧围绕“安全、有效、可控”的医疗产品研发原则,在尽可能降低产品的上市风险和使用风险前提下,解决并满足医生、患者的问题及需求。
2、“医疗AI”不属于医疗器械管理分类
最新的《医疗器械分类目录》的“医用软件”类中增加了“决策支持软件”和“体外诊断类软件”,目录中并没有“医疗AI”或“医疗人工智能”的分类。医疗AI只是俗称的人工智能技术在医疗产品研发中的技术实现手段,而不是医疗器械分类中的某一类产品。所以更谈不上什么“三类AI”和“二类AI”的区别。 例如,人们常说的“手术机器人”,在CFDA的数据库中是查不到的,“达芬奇”产品注册名称是“内窥镜手术器械控制系统”,“手术机器人”也不属于医疗器械管理分类之一。 同样,“医疗AI”与“手术机器人”都是属于商业推广概念而非法定的医疗器械概念。
3、多中心临床试验和GCP临床试验是完全不同的概念
多中心试验通常是指多家医院参与的试验,可以由企业自己主导不受行业行政主管机关的检查和监督。而GCP临床试验是特指经药监局备案或批准的,严格按照GCP规范实施完成的试验,整个试验过程要随时接受药监局的现场检查和监督,试验要经过伦理委员会的批准、试验方案要经专家评审会通过、试验对象要签署知情同意书、试验研究者必须具备GCP证书等等严格的一套规范流程。全部的试验数据和原始档案要保存在临床试验机构办至少十年随时备查。 GCP试验通常都是多中心试验,但多中心试验不一定是GCP试验。
4、“医疗AI”不可以替代医生
网络上有文章写到”用软件进行诊断、治疗、给药,直接替代医生的部分工作,……,而现代AI技术一般不会再做低等简单的工作,…..”, 这是对《目录》的错误理解。实际上,《目录》中“决策支持软件”项下各子项“预期用途”栏都明确标明“建议”、“辅助”或“参考”,包括了二类和三类产品,这和文章作者理解的 “替代”是明显不同的含义。可以确定,所谓的“医疗AI”在法规要求中是不可能“替代”或“部分替代”医生。这不是技术水平高低的问题,这是伦理和法律问题。